
Jacob Hoover
0
1485
297
Redaktørens merknad: Denne historien ble oppdatert 17. august for å inkludere:
- Data fra en studie som testet Modernas vaksine på rhesus macaque-aper
- Ny fase 1 / fase 2 datatesting Sinopharms kandidatvaksine
- Data for Johnson & Johnsons kandidatvaksine
Ved å bruke materialer fra svekkede forkjølelsesvirus til utdrag av genetisk kode lager forskere over hele verden dusinvis av unike vaksinekandidater for å bekjempe det nye koronaviruset - og de gjør det i enestående hastigheter.
Over syv måneder etter at Verdens helseorganisasjon (WHO) først varslet verden om en mystisk klynge av lungebetennelsessaker i Wuhan, Kina, er 167 kandidatvaksiner i utvikling for å forhindre koronavirus som forårsaket sykdommen (kalt COVID-19), ifølge HVEM. De fleste av kandidatvaksinene er i prekliniske stadier, noe som betyr at de fremdeles testes på dyr eller i laboratoriet, men en håndfull av dem har nådd menneskelige studier.
Slike kliniske studier er delt opp i tre til fire stadier, med tidligere stadier (fase 1 / fase 2) som undersøker sikkerheten, doseringen og mulige bivirkninger og effektiviteten (hvor bra det fungerer ved bekjempelse av patogenet) av kandidatvaksinen i en liten gruppe mennesker, ifølge Food and Drug Administration (FDA). Nøkkelen til å få en kandidatvaksine godkjent, viser imidlertid lovende resultater i den mer avanserte fase 3-studien.
I slekt: Coronavirus liveoppdateringer
I fase 3-studier tester forskere effekten av vaksinen, mens de overvåker bivirkninger hos hundrevis til tusenvis av frivillige. FDA godkjenner deretter vaksinen hvis studier viser at den er sikker og effektiv, og fordelene med vaksinen oppveier risikoen, ifølge Centers for Disease Control and Prevention (CDC). Fem vaksinekandidater mot coronavirus har begynt å rekruttere til, eller gjennomgår fase 3-studier, ifølge WHO. Her er de mest lovende av disse kandidatene:
University of Oxford / AstraZeneca

Vaksinen som for tiden kalles ChAdOx1 nCoV-19, populært kjent som Oxford-vaksinen, utvikles av det britiske universitetet i samarbeid med farmasøytisk selskap AstraZeneca. Vaksinen er laget av en svekket versjon av et vanlig forkjølelsesvirus, kalt et adenovirus, som smitter sjimpanser. Forskere endret viruset genetisk slik at det ikke kunne replikere hos mennesker og la gener til å kode for de såkalte piggproteinene som coronavirus bruker for å infisere menneskelige celler. I teorien vil vaksinen lære kroppen å gjenkjenne disse piggene, slik at når en person blir utsatt, kan immunsystemet ødelegge det, ifølge en tidligere rapport.
Forskere har tidligere testet denne vaksinen på rhesus macaque-aper og fant at den ikke forhindret apene fra å bli smittet når de bevisst ble utsatt for coronavirus, men forhindret dem i å utvikle lungebetennelse, noe som antydet at det var delvis beskyttende, ifølge en studie publisert 13. mai. til forhåndstrykkdatabasen BioRxiv.
I april begynte forskere å teste vaksinen på mennesker og publiserte tidlige resultater fra fase 1 og fortsatt pågående fase 2-studier 20. juli i tidsskriftet The Lancet. Vaksinen ga ikke noen alvorlige bivirkninger hos deltakerne, men ga noen milde bivirkninger, som muskelsmerter og frysninger. Vaksinen stimulerte immunsystemet til å produsere SARS-CoV-2-spesifikke T-celler - en gruppe hvite blodlegemer som er viktig i kampen mot patogener - og nøytraliserende antistoffer, eller molekyler som kan låse seg fast i viruset og hindre det i å infisere celler , ifølge rapporten.
Fase 3-forsøk har allerede begynt i Brasil og vil registrere opptil 5 000 frivillige. En annen fase 3-prøve er forventet å registrere ytterligere 10 500 personer i Storbritannia og 30 000 i USA, ifølge nettstedet Oxford vaksineforsøk og The New York Times. Teamet i Oxford har også uttrykt interesse for å gjennomføre utfordringsstudier på mennesker, noe som betyr at de bevisst vil infisere lavrisikofrivillige med viruset, enten ved siden av fase 3-studier eller etter at de er fullført, ifølge The Guardian.
Det amerikanske departementet for helse og menneskelige tjenester (HHS) kunngjorde at det ville gi opp til 1,2 milliarder dollar til AstraZeneca for å akselerere vaksineutviklingsprosessen og for å hjelpe selskapet med å produsere minst 300 millioner doser av vaksinen - hvis den viser seg sikker og effektiv - allerede i oktober 2020, ifølge en uttalelse. Dette er en del av Trump-administrasjonens Operation Warp Speed, et initiativ som tar sikte på å levere 300 millioner doser av en sikker og effektiv vaksine innen januar 2021, ifølge HHS.
Sinovac Biotech
En annen kandidatvaksine, kalt (PiCoVacc) og som er utviklet av Beijing-baserte Sinovac Biotech, beskyttet rhesus macaque-aper mot infeksjon med det nye coronavirus, ifølge en studie publisert 3. juli i tidsskriftet Science. Selskapet, som allerede har vist vaksinen for å være trygt og effektivt i tidlige kliniske studier, rekrutterer til en klinisk fase 3-studie med 8 870 deltakere i Brasil, ifølge clinicaltrials.gov.
Denne vaksinen består av en inaktivert versjon av SARS-CoV-2-viruset. Inaktiverte vaksiner er den døde versjonen av patogenet som forårsaker sykdommen (i motsetning til svekkede virus som er levende vaksiner), ifølge U.S. Department of Health and Human Services (HHS). Inaktiverte virus som influensavaksine eller hepatitt A-vaksine er vanligvis ikke så beskyttende som levende vaksiner og kan kreve booster-skudd over tid, ifølge HHS. I motsetning til dette er Oxford-vaksinen en svekket form for en levende vaksine, som kan skape varige immunresponser, men har en tendens til å være mer risikabelt for mennesker med svekket immunforsvar eller andre helseproblemer, ifølge HHS.
Sinovac begynte fase 1 / fase 2-forsøk (med 743 friske voksne) i april i Jiangsu-provinsen i Kina. De ga deltakerne to doser av vaksinen, med to ukers mellomrom, og rapporterte at vaksinen ikke forårsaket noen alvorlige bivirkninger, ifølge en uttalelse. Studieforfatterne sa også at mer enn 90% av deltakerne hadde utviklet nøytraliserende antistoffer mot vaksinen to uker etter å ha mottatt den andre dosen. Resultatene deres er imidlertid bare rapportert i en pressemelding og har ennå ikke blitt publisert i en fagfellevurdert tidsskrift. Selskapet gjennomfører nå en fase 2-rettssak mot eldre voksne og vil senere gjennomføre en om barn og unge, ifølge en annen uttalelse. Sinovac har tidligere brukt den samme teknologien for å lage godkjente vaksiner mot hepatitt A, hepatitt B og svineinfluensa, fugleinfluensa og viruset som forårsaker hånd-, munn- og kloftsykdom, ifølge STAT News.
Moderna / Nasjonalt institutt for allergi og smittsomme sykdommer

Denne kandidatvaksinen (mRNA-1273), utviklet av det amerikanske bioteknologiselskapet Moderna og National Institute of Allergy and Infectious Diseases (NIAID), var den første som ble testet på mennesker i USA, ifølge en tidligere rapport.
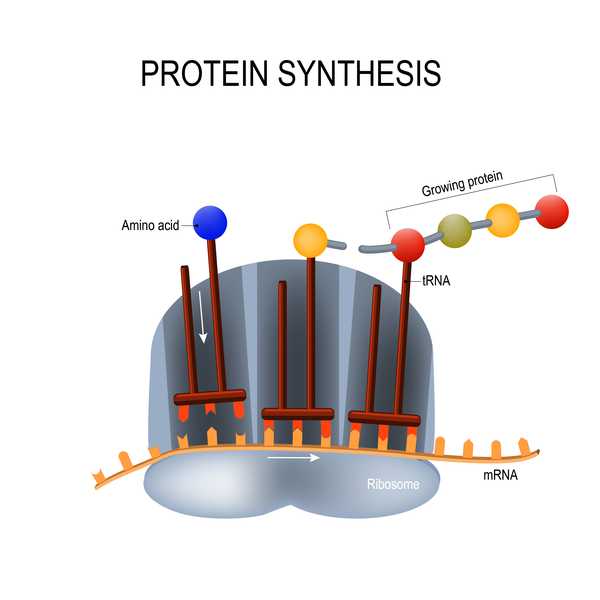
Modernas vaksine er avhengig av en teknologi som hittil ikke har blitt brukt i noen godkjente vaksiner: et stykke genetisk materiale kalt messenger RNA (mRNA). Tradisjonelle vaksiner består av svekkede eller inaktive virus, eller proteiner av disse virusene, for å utløse en immunrespons; mRNA-vaksiner er derimot sammensatt av genetisk materiale som lærer celler å bygge disse virale proteinene selv (i dette tilfellet coronavirus 'piggprotein). Både tradisjonelle og mRNA-vaksiner utløser en immunrespons i kroppen slik at hvis en person blir naturlig utsatt for viruset, kan kroppen raskt gjenkjenne og bekjempe den.
Disse mRNA-vaksinene har flere fordeler, inkludert å være raskere og enklere å produsere enn tradisjonelle vaksiner, noe som kan ta tid å utvikle seg fordi forskere må vokse og inaktivere hele patogener eller deres proteiner, ifølge National Geographic. mRNA-vaksiner kan også være mer holdbare mot patogener som har en tendens til å muteres, for eksempel koronavirus og influensavirus. Imidlertid kan mRNA-vaksiner forårsake bivirkninger i kroppen; disse typer vaksiner har også problemer med stabilitet, og brytes ganske raskt ned, noe som kan begrense styrken av immunitet, ifølge National Geographic.
mRNA-vaksiner har vist seg å være "et lovende alternativ" til tradisjonelle vaksiner, men "deres søknad har inntil nylig blitt begrenset av ustabilitet og ineffektiv" levering i kroppen, rapporterte en gruppe forskere i en anmeldelse fra 2018 publisert i tidsskriftet Nature Reviews Narkotikaoppdagelse. "Nyere teknologiske fremskritt har nå i stor grad overvunnet disse problemene, og flere mRNA-vaksineplattformer mot smittsomme sykdommer og flere typer kreft har vist oppmuntrende resultater i både dyremodeller og mennesker."
14. juli publiserte Moderna lovende tidlige resultater fra en fase 1-studie som besto av 45 deltakere i The New England Journal of Medicine. Deltakerne ble delt inn i tre grupper og gitt en lav, middels eller høy dose av vaksinen. Etter å ha fått to doser av vaksinen, utviklet alle deltakerne nøytraliserende antistoffer i nivåer over gjennomsnittet av de som ble funnet i utvinnede COVID-19 pasienter, rapportert.
Vaksinen virket trygg og generelt godt tolerert, men mer enn halvparten av deltakerne hadde noen bivirkninger (ligner bivirkninger som kan skje fra det årlige influensaskuddet) inkludert utmattethet, frysninger, hodepine, muskelsmerter og smerter på injeksjonsstedet. . Noen deltakere i mellom- og høydosegruppene opplevde feber etter den andre injeksjonen. En person som fikk den høyeste dosen opplevde en "alvorlig" feber, kvalme, svimmelhet og en episode av besvimelse, ifølge rapporten. Men denne deltakeren følte seg bedre etter halvannen dag. Slike høye doser vil ikke bli gitt til deltakere i kommende studier.
Modernas fase 2-rettssak pågår fortsatt, og 27. juli startet selskapet sin fase 3-rettssak i USA, ifølge en rapport. Rettsaken forventes å melde seg inn rundt 30 000 deltakere innen utgangen av sommeren - og de første resultatene fra rettssaken kan være tilgjengelig innen november, ifølge rapporten.
I april forpliktet HHS, under Operation Warp Speed, seg til å bruke opp til 483 millioner dollar for den hurtigere utviklingen av Modernas vaksine.
28. juli publiserte forskere en ny i The New England Journal of Medicine der detaljene om hvordan Modernes vaksine induserte en sterk immunrespons hos rhesus macaque-aper. Etter å ha fått en 10 eller 100 μg dose av vaksinen og deretter en andre dose to uker senere (noen fikk ikke vaksine og fungerte som et sammenligningspunkt), apene ble "utfordret" eller utsatt for koronaviruset i uke 8. Forskerne fant ut at apene utviklet en sterk immunrespons på viruset, da immunsystemet deres produserte både nøytraliserende antistoffer og T-celler. To dager etter at apene ble utsatt for koronaviruset, kunne forskerne ikke oppdage noen viral replikasjon i nesen eller lungene, noe som antydet at vaksinen beskyttet mot tidlig infeksjon. (Dette er i motsetning til studien fra University of Oxford utført på aper, som så ut til å forhindre at apene utviklet lungebetennelse, men ikke hindret dem i å bli smittet med det nye koronaviruset.)
CanSino Biologics / Beijing Institute of Biotechnology
CanSino Biologics utviklet i samarbeid med Beijing Institute of Biotechnology en kandidatvaksine ved bruk av et svekket adenovirus. I motsetning til Oxford-vaksinen, som er avhengig av et adenovirus som infiserer sjimpanser, bruker CanSino Biologics et adenovirus som infiserer mennesker.
Sammen med Moderna publiserte denne gruppen også resultater fra sin fase 2-rettssak 20. juli i tidsskriftet The Lancet. Forsøket, som ble utført i Wuhan (der de første tilfellene av coronavirus dukket opp), involverte 508 deltakere som tilfeldig ble gitt til å motta enten en av to forskjellige doser av vaksinen eller en placebo.
Denne studien fant heller ikke alvorlige bivirkninger, selv om noen rapporterte milde til moderate reaksjoner, inkludert feber, tretthet og smerter på injeksjonsstedet. Rundt 90% av deltakerne utviklet T-celleresponser og rundt 85% utviklet nøytraliserende antistoffer, ifølge studien.
"Resultatene fra begge studiene forbedrer godt for fase 3-studier, der vaksinene må testes på mye større populasjoner av deltakere for å vurdere deres effektivitet og sikkerhet," sa Naor Bar-Zeev og William J Moss, begge deler av John Hopkins 'internasjonale vaksine. Access Center, skrev i en tilhørende kommentar i The Lancet og refererte til denne studien og vaksinestudien i Oxford publisert i samme tidsskrift. "Totalt sett er resultatene fra begge forsøk stort sett like og lovende."
De er nå ute etter å gjennomføre en fase 3-rettssak utenfor Kina, ifølge Reuters.
Sinopharm
Den statseide China National Pharmaceutical Group (Sinopharm) 's kandidatvaksine er en inaktivert form for SARS-CoV-2. 13. august publiserte selskapet data fra kliniske fase 1 og fase 2 studier i tidsskriftet JAMA. I fase 1-studien ble 96 friske voksne tilfeldig tildelt å motta enten en lav, middels eller høy dose av vaksinen eller til å motta aluminiumhydroksyd som placebo. De fikk andre og tredje doser av vaksinen (eller placebo) etter henholdsvis 28 dager og 56 dager. Forskerne fant at vaksinen utløste kroppene deres til å produsere nøytraliserende antistoffer. Hos deltakerne som fikk placebo, hadde 12,5% bivirkninger. Hos de som fikk vaksiner mot lav, middels og høy dose, hadde henholdsvis 20,8%, 16,7% og 25% milde bivirkninger, ifølge studien. I fase 2-studien fikk 224 voksne en middels dose eller en placebo og deretter et sekundskudd enten 14 dager eller 21 dager etter den første. Igjen utviklet deltakerne nøytraliserende antistoffer og rapporterte om noen milde bivirkninger. Den vanligste bivirkningen var smerter på injeksjonsstedet og deretter lett feber. "Ingen alvorlige bivirkninger ble notert," skrev forfatterne.
Selskapet har allerede startet sin fase 3-rettssak i Abu Dhabi, som skal rekruttere opptil 15 000 mennesker, ifølge Reuters. Deltakerne vil motta en av to vaksinestammer eller en placebo, ifølge Reuters.
Pfizer / BioNTech / Fosun Pharmaceutical
Pfizer og det tyske bioteknologiselskapet BioNTech utvikler i likhet med Moderna en vaksine som bruker messenger RNA for å be immunsystemet om å gjenkjenne koronaviruset.
Vaksinen forårsaket ingen alvorlige bivirkninger og kunne anspore til et immunrespons, ifølge data fra tidlig fase 1 / fase 2 som ble utgitt til forhåndstrykkdatabasen medRxiv 1. juli, og som ennå ikke er fagfellevurdert. Studien involverte 45 pasienter som fikk en av tre doser av enten vaksine til kandidaten eller en placebo. Ingen av pasientene hadde alvorlige bivirkninger, men noen utviklet bivirkninger som feber (75% i gruppen med høyeste dose), tretthet, hodepine, frysninger, muskelsmerter og leddsmerter.
Forskerne fant at vaksinen fikk immunsystemet til å gjøre nøytraliserende antistoffer i nivåer 1,8 til 2,8 ganger høyere enn de som ble funnet hos utvunnede pasienter, ifølge studien. Senere kunngjorde Pfizer nye resultater (i en pressemelding, slik at funnene ikke er fagfellevurdert) at vaksinen også ledet til produksjon av T-celler som er spesifikke for det nye coronavirus.
Denne uken kunngjorde Trump-administrasjonen en kontrakt på 1,95 milliarder dollar med Pfizer og BioNTech om å produsere minst 100 millioner doser av vaksinen deres innen utgangen av året hvis den viser seg å være trygg og effektiv (med opptil 500 millioner doser mer etter behov) . Amerikanere ville motta vaksinen gratis, ifølge The New York Times. Tidligere kunngjorde de to selskapene en avtale med Storbritannia om 30 millioner doser av vaksinekandidaten hvis den fungerer og blir godkjent, ifølge en uttalelse. Pfizer planlegger for en storskala fase 3-utprøving som skal starte denne måneden og gjennomgang av myndighetene allerede i oktober, ifølge Times.
Johnson & Johnsons Janssen farmasøytiske selskaper
Johnson & Johnsons Janssen eksperimentelle COVID-19-vaksine, kalt Ad26, utvikles også fra et svekket adenovirus. Denne typen vaksiner kalles en vektorbasert vaksine fordi den bruker et svekket virus (en vektor) for å levere informasjon om patogenet til kroppen for å motivere immunresponsen. I dette tilfellet uttrykker det svekkede adenoviruset SARS-CoV-2 "pigg" -proteinet. Janssen bruker den samme teknologien som den brukte for å utvikle ebolavaksinen.
Forskere rapporterte 30. juli i tidsskriftet Nature at et enkelt skudd av Ad26-vaksinen beskyttet rhesusmakaker mot infeksjon med SARS-CoV-2. I denne studien testet forskerne syv litt varierende typer Ad26-vaksineprototyper og identifiserte den som produserte det høyeste antallet nøytraliserende antistoffer. Etter å ha mottatt den valgte varianten ble apene eksponert for koronaviruset. Seks av syv aper som fikk denne prototypevaksinen, kaltAd26.COV2.S, og deretter utsatt for koronaviruset, viste ikke noe påvisbart virus i nedre luftveier, og en viste svært lave nivåer i nesen, ifølge uttalelsen.
Johnson & Johnsons kliniske fase 1 / 2a-studie av Ad26.COV2.S pågår for tiden i USA og Belgia. Forsøket forventes å registrere 1.045 sunne deltakere mellom 18 og 55 år og de over 65 år. De vil teste sikkerheten til vaksinen, eventuelle bivirkninger og immunrespons deltakerne utvikler, ifølge de siste nyhetene fra Johnson & Johnson . De vil også teste forskjellige vaksinasjonsplaner og doser. Det er videre planer for en annen fase 1-studie av vaksinakandidaten i Japan og en fase 2-studie i Nederland, Spania og Tyskland, ifølge Johnson & Johnson. Hvis vaksinen viser seg sikker og effektiv i disse forsøkene, vil forskerne begynne fase 3-forsøk i september med anslagsvis 60 000 deltakere over hele kloden.
Johnson & Johnson kunngjorde nylig en avtale på 1 milliard dollar med den amerikanske regjeringen om å levere 100 millioner doser av vaksinen i USA hvis den mottar godkjenning eller godkjenning av nødbruk fra U.S. Food and Drug Administration, ifølge en uttalelse.
Se alle kommentarer (2)














